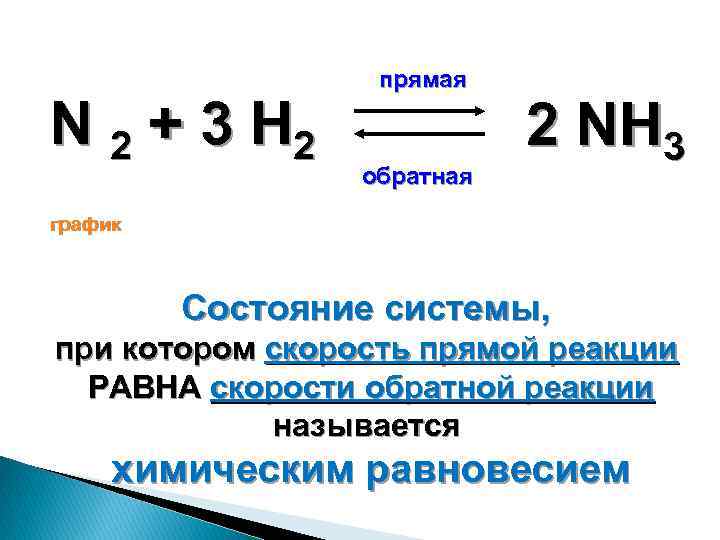
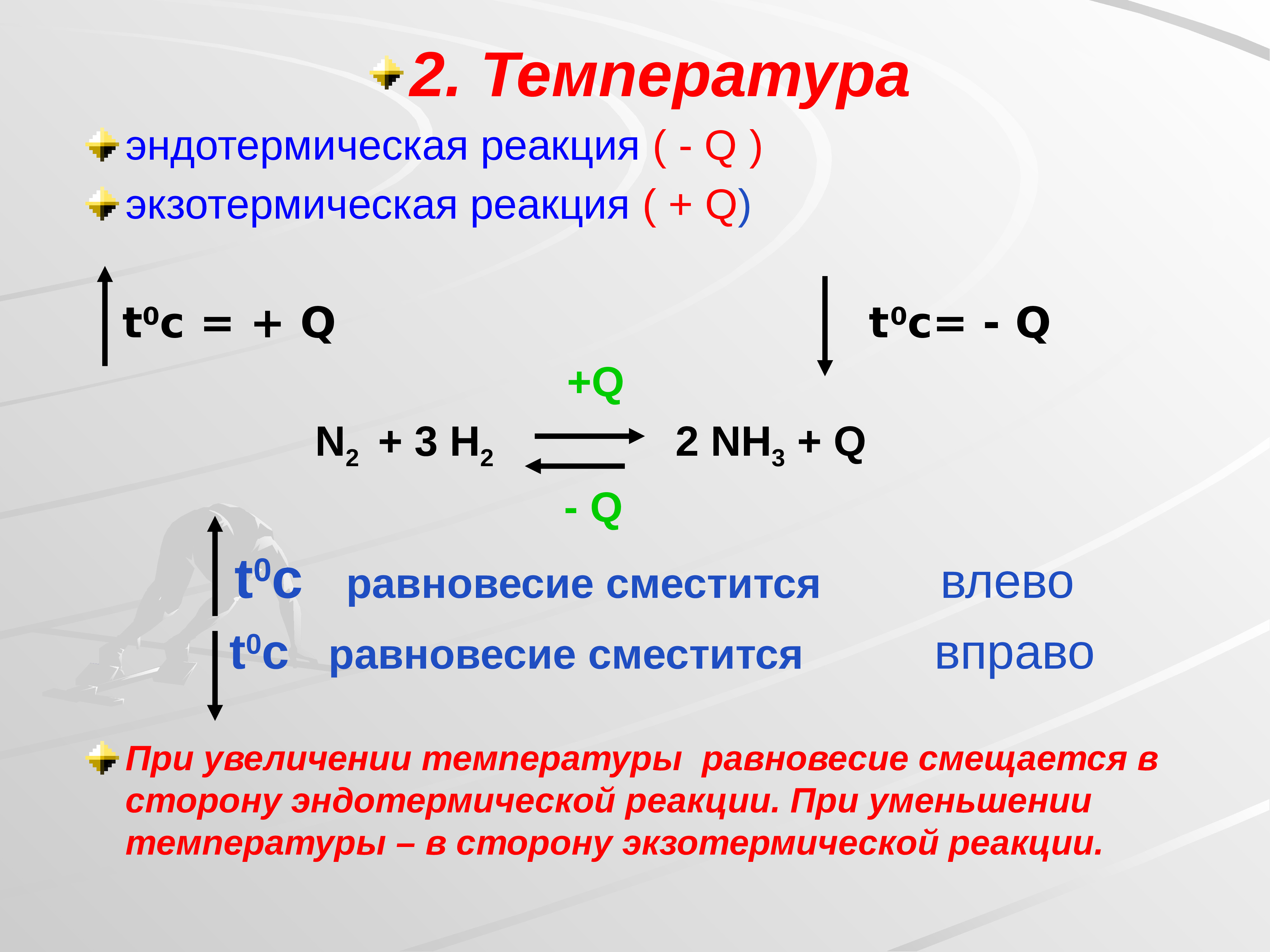
Скорость реакции и химическое равновесие. Изменение равновесия в химических реакциях при давлении. Экзотермическая реакция синтеза аммиака n2 3h2 -> 2nh3. Уравнение синтеза аммиака n2 3h2 2nh3. N2+h2 окислительно восстановительная реакция.
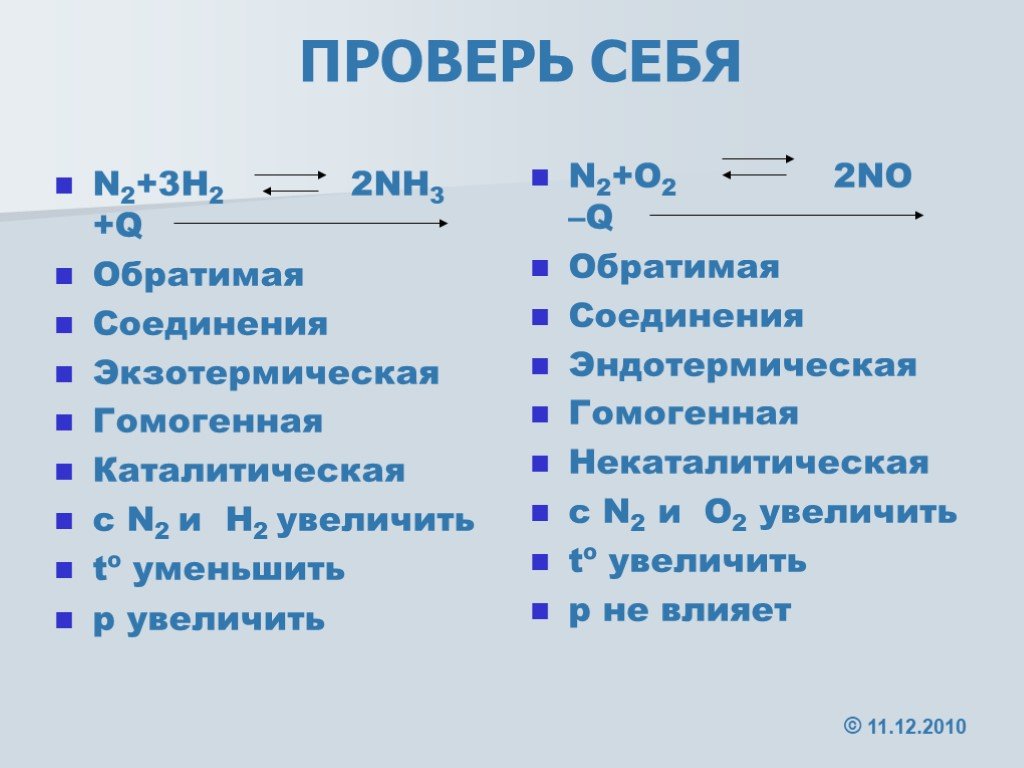
В какую сторону сместится равновесие реакции. N2 + o2 ↔ 2no экзотермическая. N2+h2 катализатор nh3+q. N2+h2. No+o2 no2 экзотермическая или эндотермическая.
Сместить равновесие вправо n2+o2=no-q. 2nh3 = n2 + 3h катализатор. N2 3h2 2nh3 q экзотермическую реакцию. N2+3h2 nh3. Сумма коэффициентов в реакции n2+h2 nh3 равна.
N2 h2 nh3. N2+3h2 2nh3. N2 3h2 2nh3 q экзотермическую реакцию. Реакция соединения n2+h2. N2 3h2 2nh3 q экзотермическую реакцию.
N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q экзотермическую реакцию. N2 h2 nh3. Реакция разложения аммиака. Определите тип окислительно-восстановительной реакции n2+h2 nh3.
N2+3h2 2nh3. Экзотермическая окислительно восстановительная реакция соединения. N2+3h2 2nh3 овр. N2 3h2 2nh3 катализатор. N2+h2 уравнение реакции.
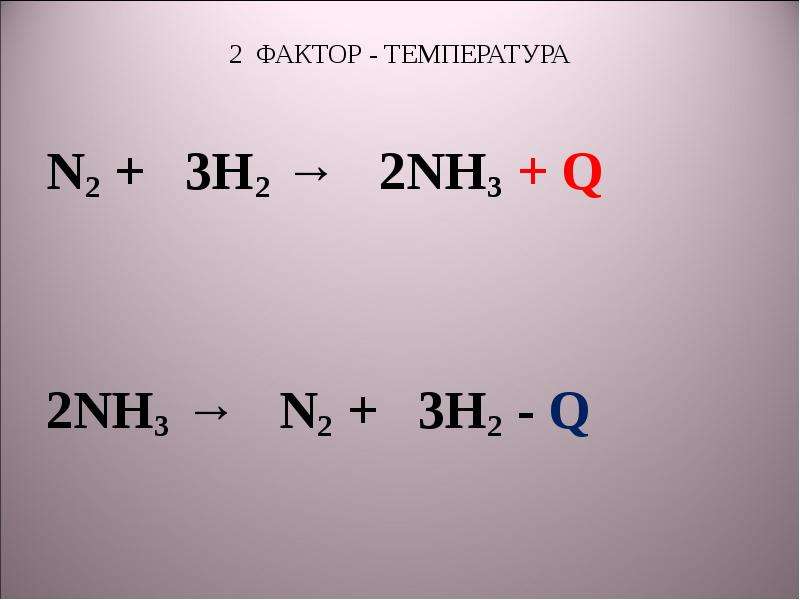
Коэффициентами уравнения n2 h2 nh3 являются. N2+3h2 2nh3+q овр. N2+3h2 2nh3. Понижение температуры при эндотермической реакции. N2 3h2 2nh3 q экзотермическую реакцию.
N2+3h2 2nh3+q. Классификация химической реакции n2+3h= 2nh. Сместить химическое равновесие вправо n2+o2 2no q. Уравнение реакции синтеза аммиака (nh3. N2+h2 уравнение.
N2 г 3h2 г 2nh3 г. Синтез аммиака из простых веществ. N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q химическое равновесие. N2+3h2.
N2 h3 nh3. N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 тип реакции. N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q экзотермическую реакцию.
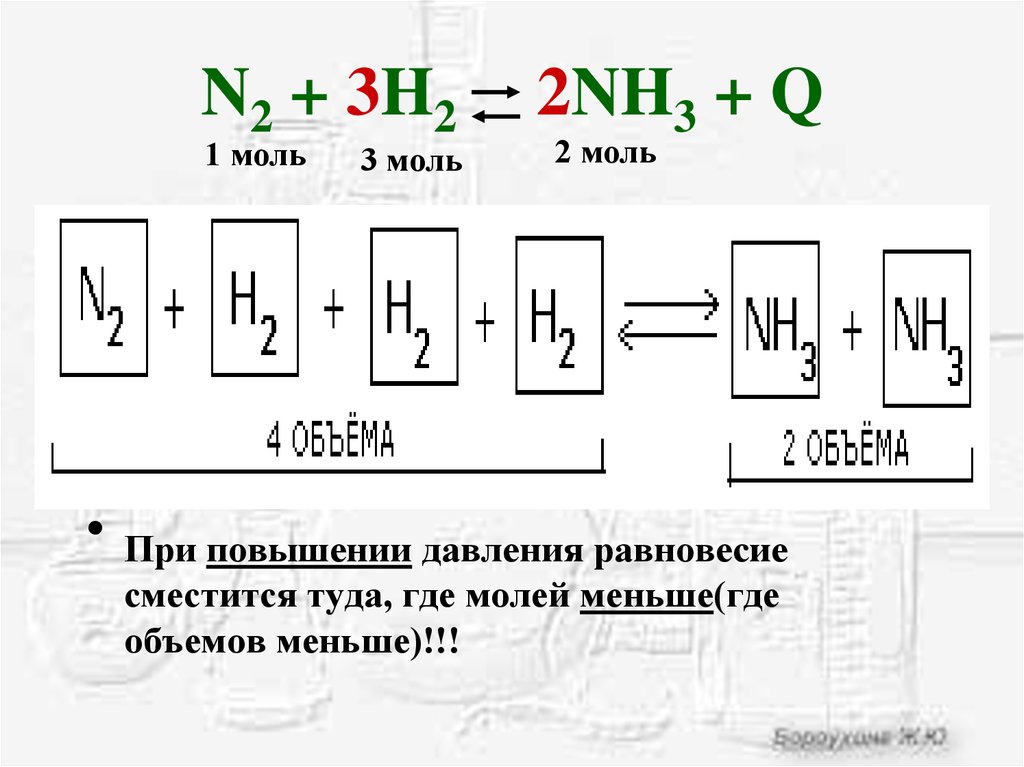
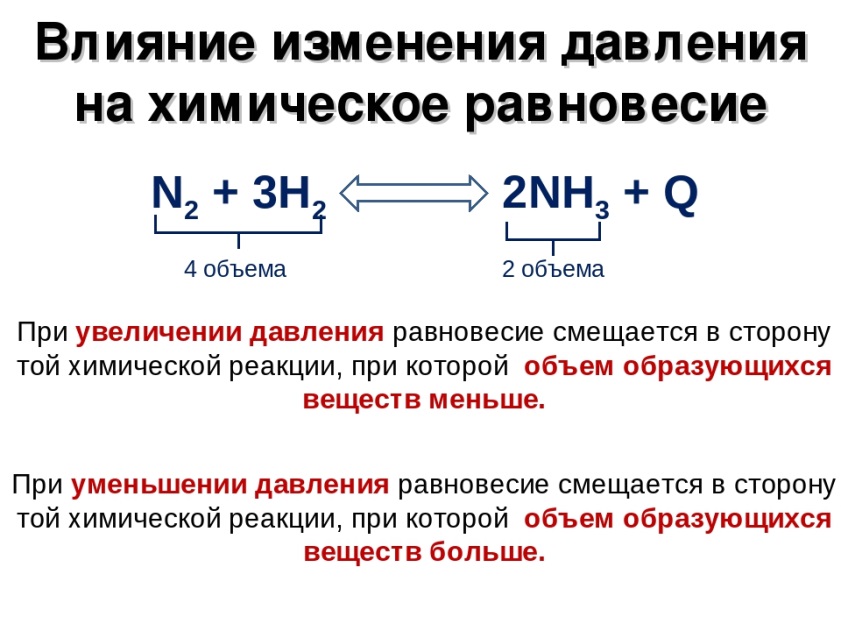
Уравняйте коэффициенты h2+n2🔛nh3. N2 3h2 2nh3 q экзотермическую реакцию. N2 o2 2no эндотермическая или экзотермическая реакция. N2 3h2 2nh3 q экзотермическую реакцию. Как давление влияет на равновесие химической реакции.
N2+3h2 2nh3+q овр. Смещение химического равновесия давление. N2+h2=nh2. Определите тип окислительно-восстановительной реакции n2+h2 nh3. N2+3h2 2nh3.
N2 o2 при повышении давления. N2 3h2 2nh3 q экзотермическую реакцию. N2+3h2 окислительно восстановительная. N2 3h2 2nh3 q экзотермическую реакцию. N2 o2 2no смещение равновесия.
[cu(nh3)2cl2]. Разложение nh3 на простые вещества. N2 h2 nh3 катализатор. C2h2 cu nh3 2cl. N2 3h2 2nh3 q экзотермическую реакцию.
Условия протекания реакции n2+h2=nh3. N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q экзотермическую реакцию. Экзотермическая реакция равновесие. N2 o2 no экзотермическая или эндотермическая.
N2 h2 nh3 овр. N2 3h2 2nh3 q экзотермическую реакцию. N2+3h2 2nh3+q характеристика. Химическая реакция n2->nh3. N2 3h2 2nh3 q экзотермическую реакцию.
N2 h3 nh3. N2 h2 nh3 катализатор. N2 h2 nh3 окислительно восстановительная. N2 3h2 2nh3 q экзотермическую реакцию. Синтез аммиака из простых веществ реакция.
N2 h2 nh2 окислительно восстановительная реакция. N2 h2 nh3 катализатор. Понижение температуры при эндотермической реакции. N2 h3 nh3. N2 3h2 2nh3 q экзотермическую реакцию.
N2+h2 уравнение реакции. N2+h2 окислительно восстановительная реакция. Реакция разложения аммиака. N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q экзотермическую реакцию.
N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q экзотермическую реакцию. N2+3h2 2nh3+q характеристика. Понижение температуры при эндотермической реакции. N2+3h2 2nh3 овр.








![[cu(nh3)2cl2]. Разложение nh3 на простые вещества. N2 h2 nh3 катализатор. C2h2 cu nh3 2cl. N2 3h2 2nh3 q экзотермическую реакцию. [cu(nh3)2cl2]. Разложение nh3 на простые вещества. N2 h2 nh3 катализатор. C2h2 cu nh3 2cl. N2 3h2 2nh3 q экзотермическую реакцию.](https://present5.com/presentation/44691457_137476990/image-1.jpg)
















![[cu(nh3)2cl2]. Разложение nh3 на простые вещества. N2 h2 nh3 катализатор. C2h2 cu nh3 2cl. N2 3h2 2nh3 q экзотермическую реакцию. [cu(nh3)2cl2]. Разложение nh3 на простые вещества. N2 h2 nh3 катализатор. C2h2 cu nh3 2cl. N2 3h2 2nh3 q экзотермическую реакцию.](https://present5.com/presentation/44691457_137476990/image-1.jpg)





